Primeras descripciones sobre la nidotópica del cóndor andino Vultur gryphus
La ecología reproductiva del cóndor andino es poco conocida, este articulo describe eventos reproductores de parejas individuales y es un trabajo pionero sobre nidotípica, describimos las distancias mínimas entre los sitios de anidación, el éxito de anidación, la altitud y el uso de acantilados de cría de diferentes parejas de cóndor andino en el Andes del centro – norte del ecuador. Los eventos de anidación controlados en dos años, ocurrieron en un gradiente de altitud de entre 2500 y 4500 metros. Se describe por primera vez dos eventos de cria simultáneos de dos parejas diferentes en un mismo acantilado, a 310 metros un nido de otro.
Text in English after Spanish – Downloadable in PDF at the end of the post
La nidotópica, consiste, en el estudio de las características de los nidos y la selección y características del hábitat de cría. En esta materia muchas para de las especies de aves neotropicales es un aspecto desconocido, bien por qué se conocen pocos nidos o eventos reproductores o porque nunca se ha descrito un evento reproductivo y se desconoce su comportamiento reproductor, estamos ante un aspecto importante y las investigaciones en este campo deben de ser prioritarias. En aves rapaces, la mayoría de los censos se basan en el número de nidos ocupados por parejas reproductoras (González et al. 2008), un censo sistemático bien planificado, delimitado y una escala temporal amplia, nos ayuda a comprender aspectos tan relevantes como la tendencia poblacional, densidades de población e incluso el estado de conservación. Aunque, también se han desarrollado otras metodologías para censar, como los índices de abundancia o los conteos simultáneos en dormideros, aunque con estos últimos pueden existir variables que pueden condicionar los resultados.
El sitio de anidación es fundamental para la reproducción de las aves ya que una buena elección de la ubicación puede mejorar su éxito reproductivo (Podofillini et al. 2018). Las aves rapaces que anidan en rocas tienen mayor probabilidad de éxito en la cría cuando anidan en sitios previamente utilizados (Negro & Hiraldo 1993, Podofillini et al. 2018). Sin embargo, el éxito es mayor cuando los nidos están ubicados en sitios inaccesibles a perturbaciones o depredadores (Negro & Hiraldo 1993).
Fotografía 1: Pareja de cóndor andino en un nido ocupado en el distrito metropolitano de Quito. El nido se encuentra en una o quedad en un acantilado totalmente vertical e inaccesible, octubre 2021. Photography 1: Andean condor pair in an occupied nest in the metropolitan district of Quito. The nest is located in an area on a completely vertical and inaccessible cliff, October 2021. R Sánchez ©. www.raptorsoftheworld.org
El Cóndor Andino (Vultur gryphus) puede alcanzar 1,30 m de altura, una envergadura de 3,2 m y pesar hasta 15 kg, lo que lo convierte en una de las aves voladoras más grandes del planeta (Houston et al., 2020). Es una especie endémica de America del sur, actualmente, se distribuye desde el norte de Venezuela hasta el sur de Tierra de Fuego. Se distribuye por toda la cordillera de los andes, en un gradiente altitudinal desde el nivel del mar hasta > 7000 metros (Astore et. al. 2017. Houston et al., 2020). Es una especie vulnerable (VU) (UICN 2020), pero las poblaciones del norte están consideradas como en peligro de extinción (EN) (Houston et al., 2020).
El hábitat que ocupa a nivel global puede superar los 50.000 km2 (Lambertucci et al. 2014, Pavez 2014), dentro de su área de distribución la especie utiliza grandes acantilados, para posarse durante el día o pasar la noche en dormideros comunales (Lambertucci 2007). Los nidos también los ubican sobre acantilados pero hasta ahora solo se han descrito criando parejas en solitario. Todas las publicaciones describen la anidación de una sola pareja por acantilado (Köster 1997 & Mastrantuoni 2008, Heredia & Piedrabuena 2010, Sáenz-Jimenez et al. 2016, Restrepo-Cardona et al. 2018). Es una especie con un bajo indice de productividad (Lambertucci 2007). El periodo de reproducción del cóndor es largo y las interacciones dentro de una pareja antes de la puesta de huevos pueden durar entre ocho y nueve meses durante el cual ocurre el cortejo y la selección de un sitio de nidificación (Lambertucci 2007). Tienen un periodo de incubación de dos meses y un periodo de vuelo de dependencia posterior al vuelo que dura entre ocho y doce meses, lo que resulta en un periodo de cría exitoso de mas de 12 meses (Lambertucci 2007, MacGahan 2011, Houston et al., 2020)
La reproducción probablemente solo ocurre en años alternos o quizás una vez cada dieciocho meses, si un intento de cría tiene éxito (Wallace & Temple 1987, MacGahan & Sale 2011, Houston et al., 2020). Mientras que muchas parejas pueden no reproducirse en absoluto cuando las condiciones de alimentación son malas. (Houston et al.2020).
Las aves rapaces utilizan diferentes estrategias para poner sus huevos; la mayoría construye nidos utilizando palos y otros restos vegetales, mientras que otros, en lugar de construir sus propios nidos, el de otras especies y unas pocas especies ponen sus huevos directamente en el suelo. Este comportamiento puede estar asociado al proceso evolutivo de las especies, una mayor o menor habilidad para la construcción de nidos puede condicionar por ejemplo a la selección del hábitat.
Fotografía 1: Pareja de cóndor andino en un nido ocupado en el distrito metropolitano de Quito. El nido se encuentra en una o quedad en un acantilado totalmente vertical e inaccesible, octubre 2021. Photography 1: Andean condor pair in an occupied nest in the metropolitan district of Quito. The nest is located in an area on a completely vertical and inaccessible cliff, October 2021. R Sánchez ©. www.raptorsoftheworld.org
El Cóndor Andino, como la mayoría de los Cathartidae, al poner el huevo directamente sobre el suelo, utiliza peñascos rocosos para descansar, así como cuevas y cornisas para reproducirse, si estos sitios están protegidos del mal tiempo y otras amenazas (Lambertucci 2007, Lambertucci & Ruggiero 2013, Houston et al. 2020). Se ha observado la reutilización de los sitios de anidación en cóndor andino (Koford 1953, Snyder & Hamber 1985; Snyder et al. 1986, Lambertucci & Speziale 2009, Heredia & Piedrabuena 2010, Gargiulo 2012). Para el cóndor de California Gymnogyps californianus , las distancias entre los sitios de anidación de cuatro parejas diferentes varían desde la reutilización de nidos hasta 11,5 km (Snyder & Hamber 1985, Snyder et al. 1986). Las distancias entre los nidos del Cóndor Andino son desconocidas o inéditas y solo encontramos referencias de reutilización en Argentina (Heredia & Piedrabuena 2010, Gargiulo 2012).
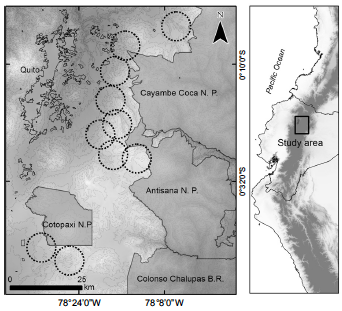
Fig. 1. Prospecting areas searched for nesting Andean Condors in the north-central Andes of Ecuador between 2018–2019. 5 km buffer zones in black dotted lines within P.N. = National Park and R.B. = Biological Reserve were not surveyed.
Para obtener esta información visitamos 10 áreas entre 2500 y 4500 m snm en los Andes en las provincias de Cotopaxi Napo y Pichincha en el centro-norte de Ecuador (Fig. 1). Estas áreas comprendían diversos paisajes incluyendo el bosque altoandino, los páramos andinos y áreas perturbadas (pastos, áreas agrícolas y plantaciones forestales). Todas las áreas encuestadas estaban fuera del Sistema Nacional de Áreas Protegidas (MAE 2017).

El páramo andino es un ecosistema neotropical de alta montaña, con pastizales húmedos intercalados con matorrales y parches de bosque bajo (Avellaneda et al. 2018, Morocho & Chuncho 2019). Los páramos ocupan el cinturón de vegetación entre el límite superior del bosque nuboso montano y la línea de nieve que se encuentra entre 4700 y 4800 m snm (Christmann & Oliveras 2020). Este tipo de ecosistema se distribuye desde Venezuela hasta el norte de Perú, y algunos parches entre Costa Rica y Panamá (Buytaert et al.2006). Los páramos andinos han perdido hasta el 75% de su cobertura original debido a muchas perturbaciones y destrucción que resultaron en una extensa fragmentación (Hofstede et al. 2002). Fuera del páramo andino, la deforestación se acercó al 50% en 2010, con tendencias crecientes en las áreas agrícolas circundantes (Sierra 2013). Los bosques altoandinos están compuestos por bosque nuboso, bosque de montaña y bosque de alta montaña e incluyen las siguientes formaciones vegetales: bosque siempre-verde alto montano de la cordillera nororiental de los Andes, matorral siempre-verde montano de los Andes norte, matorral siempre-verde y páramo herbáceo (MAE 2013). Los páramos, matorrales y bosques altoandinos tienen un clima estacional con precipitación promedio anual que varía entre 1300 y 1450 mm y temperaturas promedio mensuales entre 6 y 12,7 °C (Josse & Aguirre 2013, Santiana et al. 2013).

Recopilamos datos durante más de 72 días laborables (840 horas), entre septiembre de 2018 y diciembre de 2019. Además, recopilamos información sobre todos los eventos reproductivos en el área de estudio entre 1996 y 2017 mediante la realización de entrevistas con personas conocedoras y la búsqueda de literatura apropiada para Registros de anidación de cóndores. Para nueve de los doce eventos de reproducción que ocurrieron antes de nuestro estudio, registramos las ubicaciones exactas de los nidos con base en entrevistas a naturalista locales, mientras que los otros tres restantes se ubicaron utilizando referencias bibliográficas (Köster 1997, Vargas et al.2013, 2017). Para los registros anteriores a nuestro período de estudio, no se puede determinar el número de parejas reproductoras. De los ocho registros de nidos obtenidos durante nuestro período de estudio, siete corresponden a parejas distintas. Diferenciamos las parejas reproductoras porque todos los nidos observados coincidieron durante gran parte del periodo de reproducción (cortejo, incubación, cuidado parental en el nido y periodo de dependencia), en la mayoría de los casos en diferentes acantilados, distantes entre sí. Además de los períodos reproductivos parcialmente superpuestos, los machos fueron identificados por las características de las carúnculas individualmente variables (Ríos-Uzeda & Wallace 2007, McGahan & Sale 2011, Houston et al. 2020), las hembras se diferenciaron por el proceso de muda de las plumas de vuelo (muda completa de las plumas de vuelo de las alas o no). En todos los nidos que observamos, los huevos fueron puestos en el suelo sobre sustratos arenosos y durante la prepuesta, la incubación y el cuidado parental no se observó ningún adulto trayendo material al nido. Esto dificulto la localización de los nidos.

Photograph 5: Detail of the caruncle of one of the adult males of the Andean condor under study.
R. Sánchez 2019 ©
www.raptorsoftheworld.org
La frecuencia de nuestras visitas dependió de la actividad de las aves en los nidos. Los nidos activos fueron visitados al menos cuatro veces al mes y los nidos no activos, una vez al mes. Las observaciones se realizaron entre las 6:00 y las 18:00 y se realizaron lejos de los nidos y sitios de percha para garantizar que no haya influencia negativa en el comportamiento de las parejas reproductoras bajo observación. Registramos la ubicación de los nidos, la actividad en cada nido: polluelos, parejas o individuos de Cóndores Andinos.
Se consideró como un caso de superposición parcial en la época reproductiva entre parejas cuando dos parejas diferentes se reproducen en el mismo período de tiempo, pero pueden estar en diferentes etapas de su reproducción (incubación, crianza de pollos y durante el periodo de dependencia). Consideramos periodo de cría como el tiempo que transcurre entre la puesta del huevo y el final del periodo de dependencia del emplumado. Las parejas se consideraron como vecinas cuando dos parejas se reproducen dentro del mismo período. Se considera compartir el acantilado cuando dos parejas diferentes crían en el mismo acantilado independientemente de que sea el mismo periodo de reproducción.
El éxito reproductivo, medido como el número de polluelos por año que volaron con éxito en comparación con el número de nidos activos, se utilizó como parámetro reproductivo (Margalida et al. 2007) según la clasificación de Cheylan (1981). Para analizar las relaciones entre el éxito reproductivo y la ocupación de nidos o elevación de nidos realizamos pruebas exactas de Fisher. Este análisis se realizó en el programa R (R Development Core Team 2017). Los nidos fueron georreferenciados mediante triangulación con ayuda de brújula y GPS con el fin de generar el menor impacto en el sitio de anidación. La elevación se determinó mediante un modelo digital de elevación (MAGAP 2020). También calculamos la distancia media y los rangos de distancia entre nidos.
Entre 1996 y 2019 se registraron 21 intentos de reproducción del Cóndor Andino en 16 sitios de anidación diferentes. La distancia mínima registrada entre los 16 sitios de anidación fue de 25 m (rango de 25 a 87,278 m), a una elevación media de 3478 m snm (rango de 2930 a 4140 m). Durante nuestro período de estudio de campo, la distancia mínima entre las parejas reproductoras de Cóndores Andinos fue de 310 m (rango de 310 a 86,868 m) y una elevación media de 3429 m snm. (rango 3200–4140 m).
En dos áreas determinamos que la distancia al vecino más cercano (NND) de los cóndores andinos en el mismo acantilado fue de 556 m (media 3047 m, SD = 1761,4, N = 3, rango de 556 a 4305 m) (Fig. 2; Área 1 ; nidos; 1–3, pares 1– 3), en diferentes acantilados 2720 m (sólo dos pares) (Fig. 2; Área 2; nidos; 4–5, pares 4–5) y en ambas áreas el vecino más cercano medio la distancia registrada fue 2370,889 m (SD = 1468,246, N = 4, rango 556 a 4305 m).
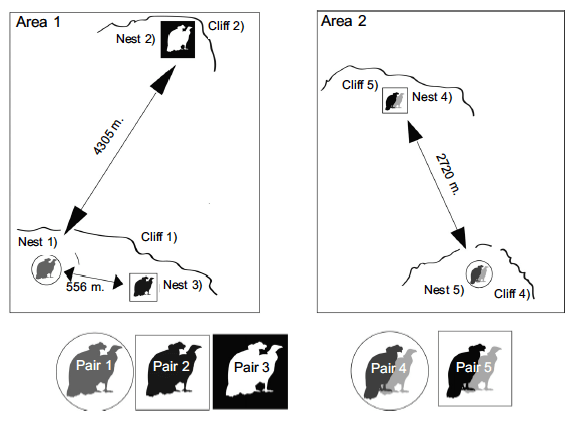
Fig. 2. Distances between nests of different breeding pairs breeding simultaneously in two areas of the north-central Andes of Ecuador.
Se observaron dos casos de acantilados compartidos en diferentes áreas. En un acantilado, se observaron dos polluelos consecutivos, no simultáneos, con los machos de las dos parejas identificados por los lóbulos de la carancula. pero no se observaron diferencias entre las hembras. El segundo caso fue de Simultáneo compartiendo el mismo acantilado con dos parejas. teniendo intentos de reproducción parcialmente superpuestos. La primera pareja tenía un novato macho dependiente con una marca de identificación mientras el segundo par comenzaba cría; Ambas parejas tuvieron éxito. La primera El polluelo de la pareja permaneció cerca del acantilado hasta que El polluelo de la segunda pareja alcanzó los tres meses de edad. Ambas parejas en este acantilado compartieron 159 días.
El éxito reproductivo para el cóndor andino en el área de estudio para los años 2018 – 2019 fue de 0,75 pollos por nido. Cuando se compararon los lugares de nidificación utilizados en una ocasión con los que fueron recurrentes encontramos si encontramos diferencias estadísticamente significativas, teniendo mayor éxito las parejas que criaron en nidos recurrentes 1,0 vs 0,58. El éxito reproductivo no estuvo asociado con la altitud, siendo las zonas de menor altitud las más humanizadas.

Photograph 6: juvenile during the first flights with the male, near the nest.. R. Sánchez 2020 © www.raptorsoftheworld.org
En este trabajo se describe información inédita y desconocida sobre nidotípica, información sobre las distancias mínimas entre nidos ocupados en diferentes eventos reproductivos y distintas parejas reproductoras, elevación y Ecología reproductiva del cóndor andino en Ecuador. La distancia de 25 m es la mínima registrada en 21 intentos reproductivos sin diferenciar parejas reproductoras y en diferentes periodos reproductivos, siendo 310 m la distancia mínima registrado en cría parcialmente superpuesta de siete parejas (entre 2018 y 2019). Estos rangos variarán debido a la presencia de áreas cercanas que no fueron inspeccionados intensivamente donde pueden existir más nidos. Sin embargo, en dos áreas donde hicimos búsqueda intensiva de nidos (Fig. 2), la media entre nidos de diferentes parejas y en los mismos periodos reproductivos fue de 2956,3 m (SD = 1532 m) y la distancia entre nidos más cercanos vecinos que compartían el mismo acantilado medía 556 m y 2720 m en diferente acantilado. Estas serían las distancias más cortas descritas para el Cóndor Andino entre intentos de reproducción de diferentes especies parejas, con la misma temporada de reproducción parcialmente superpuesta.
La distancia media entre eventos de anidación de las parejas de cóndores de California alcanzan los 3800 m en una población reproductora reducida (Snyder et al. 1986). En el cóndor andino, la distancia media de 2956,3 m entre nidos registrados en dos áreas diferentes (Fig. 2) es ligeramente menor que el valor encontrado para el Cóndor de California. Es probable que esta similitud podría estar asociado con el pequeño número de parejas reproductoras conocidas para el Ecuador.
Nuestras observaciones sobre el uso compartido de acantilados son únicas. En un mismo acantilado descubrimos dos parejas reproductoras en diferentes estados reproductivos, lo que evidencia la posible presencia de más parejas reproductoras en la zona y la no exclusividad del acantilado para una pareja. El descubrimiento de dos parejas reproductoras de cóndor andino que compartían el mismo acantilado muestra un comportamiento sin precedentes y no descrito hasta el momento. Las parejas de cóndores andinos aplican un patrón de anidación solitario (Lambertucci 2007, Houston et al. 2020). Nuestras observaciones muestran que en el Cóndor Andino, ademas de la anidación solitaria puede coincidir con el hecho de que dos parejas de anidación comparten acantilados.
Las distancias mínimas entre los sitios de reproducción y las distancias promedio entre vecinos más cercanos que encontramos para el cóndor andino en nuestro estudio son cortas en comparación con el hecho de que los cóndores suelen recorrer una distancia máxima de vuelo de 349,5 km/día (Lambertucci et al. 2014) o 362 km/día (Pávez 2014). Estas distancias relativamente cortas entre los sitios de anidación probablemente sean un reflejo de la disponibilidad de recursos alimentarios, o de que los sitios de cría se utilizan preferentemente o que las áreas de cría son escasas. Se sabe que los recursos alimentarios impactan directamente la actividad reproductiva del Cóndor Andino (Wallace & Temple 1988). Un hábitat de alta calidad cerca de los sitios de cría podría ser un factor explicativo para comprender las distancias entre los vecinos más cercanos (Donázar et al. 1999). Estas mediciones son variables que no han sido consideradas previamente en otros estudios ecológicos del Cóndor Andino debido a la limitada información sobre su ecología reproductiva (Sáenz-Jiménez et al. 2016). Nuestra información contribuye a cubrir este vacío de información, pero otros aspectos sociales de la dinámica reproductiva del Cóndor Andino podrían explicar mejor estas distancias, por lo que es importante ampliar y profundizar ene este tipo de investigaciones.
Los nidos ocupados con mayor frecuencia son los más productivos y han mostrado un mayor éxito reproductivo. Esto puede deberse a que los acantilados son inaccesibles o que los sitios de anidación (nidos) tienen algunas características estructurales y ambientales especiales, o que determinadas parejas reproductoras son especialmente buenas para reproducirse. La presencia de parejas reproductoras exitosas anima a otras parejas a anidar en los mismos acantilados o en acantilados cercanos. De hecho, en otras especies de rapaces se encontró que nuevas parejas se asentaban entre nidos ya ocupados (Margalida et al. 2008).
Durante nuestro estudio, no registramos ninguna pérdida de puesta, lo que sugiere que el éxito reproductivo que medimos puede estar sobreestimado. En el cóndor de California y otras especies de buitres grandes como el buitre negro (Aegypius monachus) o el buitre del Cabo (Gyps coprotheres) en poblaciones con preocupaciones de conservación similares, el éxito reproductivo es ligeramente menor (Borello & Borello 2002, Terrasse et al. 2004, Mee et al. 2007, Freund et al. 2017) que la registrada para el Cóndor Andino en este estudio. Nuestra investigación muestra que de las fallas de anidación que observamos, dos ocurrieron en áreas perturbadas donde se necesitan acciones de manejo de inmediato.
Finalmente, nuestros resultados resaltan la importancia de monitorear las áreas de anidación y crean nuevas preocupaciones para la conservación del Cóndor Andino. Es probable que se esté subestimando el número de parejas reproductoras y de zonas de anidación. Los sitios de anidación y refugios del Cóndor Andino presentan una dinámica interesante sobre la cual se sabe poco (Lambertucci et al. 2008). Ahora sabemos que las parejas de cóndores pueden compartir el mismo acantilado y que se pueden registrar nidos en distancias muy cortas. Nuestros resultados respaldan la opinión de que la conservación de redes de refugio conocidas sería una buena estrategia de conservación (Kusch 2004, Lambertucci et al. 2008). Esperamos que en el corto plazo se desarrollen estrategias de manejo efectivas en torno a la ecología reproductiva para la conservación y persistencia del Cóndor Andino en los Andes ecuatorianos.
Citar como / Cite as: Mateos, R.S. & Gallo-Viracocha F. 2023. Primeras descripciones sobre la nidotípica del cóndor andino Vultur gryphus. Eagle News, Ecología y Conservación de las Rapaces entrada 88.
Mateos, R.S. & Gallo-Viracocha F. 2023 First descriptions of the characteristics of the nests of the Andean condor Vultur gryphus. Eagle News, Ecology and Conservation of Raptors post 76.
Este articulo esta extraído de / This article is taken from:
Mateos, R. S., & Gallo-Viracocha, F. (2023). Minimum Nest Distances, Breeding Success and Use of Shared Cliffs for Andean Condor Vultur gryphus Breeding in Ecuador. Acta Ornithologica, 58(1), 127-133.
First descriptions of the characteristics of the nests of the Andean condor Vultur gryphus
The reproductive ecology of the Andean condor is little known, this article describes reproductive events of individual pairs and is a pioneering work on nesting. We describe the minimum distances between nesting sites, nesting success, altitude and the use of breeding cliffs. of different pairs of Andean condor in the central Andes – north of the equator. The controlled nesting events in two years occurred at an altitude gradient between 2500 and 4500 meters. For the first time, two simultaneous breeding events of two different pairs are described on the same cliff, one nest 310 meters from the other.
Sanchez Mateos R., Gallo-Viracocha.
This study describes the characteristics of Andean Condor nests, something unprecedented until now. In this matter, many of the species of Neotropical birds are an unknown aspect, either because few nests or reproductive events are known or because a reproductive event has never been described and their reproductive behavior is unknown. This is an important aspect and research in this field they must be a priority. In birds of prey, most censuses are based on the number of nests occupied by breeding pairs (González et al. 2008); a well-planned, delimited systematic census with a broad temporal scale helps us understand aspects as relevant as population trend, population densities and even the state of conservation. However, other census methodologies have also been developed, such as abundance indices or simultaneous roost counts, although with the latter there may be variables that can condition the results.
The nesting site is fundamental for the reproduction of birds as a good choice of location can improve their reproductive success (Podofillini et al. 2018). The raptors that nest on rocks have a higher probability of nesting success when nest- ing in previously used sites (Negro & Hiraldo 1993, Podofillini et al. 2018). However, the success is higher when nests are located in sites inaccessi- ble to disturbance or predators (Negro & Hiraldo 1993).
The Andean Condor Vultur gryphus can reach 1.30 m height, wingspan of 3.2 m and weigh as much as 15 kg, making it one of the largest flying birds on the planet (Houston et al. 2020). It is an endemic species of South America; it is distributed from the north of Venezuela to the south of Tierra del Fuego. It is present in all the Andean moun- tain range in an altitudinal gradient from sea level to > 7000 m (Astore et al. 2017, Houston et al. 2020). It is a Vulnerable (VU) species (IUCN 2020), but northern populations are listed as Endangered (EN) (Houston et al. 2020).
The home range of the Andean Condor can exceed 50,000 km2 (Lambertucci et al. 2014, Pavez 2014). In this area the species uses large cliffs, to perch during the day or to spend the night in communal roosts (Lambertucci 2007). Similar places are used as nesting sites but in pairs soli- tary. Descriptions of nesting have reported the presence a single pair on isolated cliffs (Köster 1997, Lambertucci & Mastrantuoni 2008; Heredia & Piedrabuena 2010; Sáenz-Jiménez et al. 2016; Restrepo-Cardona et al. 2018). It is a species with a low productivity rate (Lambertucci 2007). The breeding period of the Andean Condor is long and interactions within a pair prior to egg laying can last between eight and nine months during ahich courtship occurs and a nest site selected (Lambertucci 2007). Andean Condors have a two- month-long incubation period and a post fledging dependency period lasting eight–twelve months, which results in the case of a successful nesting attempt exceeding twelve months (Lambertucci 2007, MacGahan & Sale 2011, Houston et al. 2020).
Breeding probably only occurs in alternate years or perhaps once every 18 months if a nesting attempt is successful (Wallace & Temple 1987, McGahan & Sale 2011, Houston et al. 2020), whereas many pairs may not breed at all when feeding conditions are poor (Houston et al. 2020).
Birds of prey use different strategies to lay their eggs; most build nests using sticks and other plant debris, while others instead of building their own nests, parasitize nests of other species, and a few species lay their eggs directly on the ground.
The Andean Condor, like most Cathartidae, being characterized by this last behavior, uses rocky crags to roost as well as caves and ledges to rest and breed (Lambertucci 2007, Houston et al. 2020) if these sites are protected from bad weather and other threats (Lambertucci 2007, Lambertucci & Ruggiero 2013). Nest site reuse has been observed in condors (Koford 1953, Snyder & Hamber 1985; Snyder et al. 1986; Lambertucci & Speziale 2009, Heredia & Piedrabuena 2010; Gargiulo 2012). For the California Condor Gymnogyps californianus dis- tances between nest sites of four different pairs vary from nest reuse to 11.5 km (Snyder & Hamber 1985, Snyder et al. 1986). The distances between Andean Condor nests are unknown or unpub- lished and we only found references to reuse in Argentina (Heredia & Piedrabuena 2010, Gargiulo 2012).
We visited 10 areas between 2500 and 4500 m a. s.l. in the Andes in the provinces of Cotopaxi Napo and Pichincha of north-central Ecuador (Fig. 1). These areas comprised various landscapes includ- ing the high Andean forest, Andean paramos and disturbed areas (pastures, agricultural areas and forest plantations). All areas surveyed were out- side the National System of Protected Areas (MAE 2017).
The Andean paramo is a high-mountain neotropical ecosystem, with humid grasslands interspersed with scrubland and patches of short forest (Avellaneda et al. 2018, Morocho & Chuncho 2019). The Paramos occupy the vegeta- tion belt between the upper limit of the montane cloud forest and the snow-line occurring at 4700–4800 m a.s.l. (Christmann & Oliveras 2020). This type of ecosystem is distributed from Venezuela to northern Peru, and some patches between Costa Rica and Panama (Buytaert et al. 2006). The Andean paramos have lost up to 75% of their original coverage due to much disturbance and destruction resulting in extensive fragmenta- tion (Hofstede et al. 2002). Outside the Andean paramo, deforestation came close to 50% in 2010, with increasing trends in the surrounding agricul- tural areas (Sierra 2013). The high Andean forests are composed of cloud forest, mountain forest and high mountain forest and include the following plant formations: high montane evergreen forest of the north-eastern Andes mountain range, mon- tane evergreen shrubland of the northern Andes, evergreen shrubland and herbaceous paramo (MAE 2013). The paramos, shrubland and high Andean forest have a seasonal climate with aver- age annual precipitation varying between 1300 and 1450 mm and average monthly temperatures between 6 and 12.7 °C (Josse & Aguirre 2013, Santiana et al. 2013).
We collected data during over 72 workdays (840 hours), between September 2018 and December 2019. Additionally, we collected information on all breeding events in the study area between 1996 and 2017 by conducting interviews with knowl- edgeable people and by searching appropriate lit- erature for records of condor nesting. For nine of the twelve breeding events occurring prior to our study, we recorded exact nest locations based on interviews (A. de Pazo A. & J. Carrión, pers. com.) while the remaining three others were located using bibliographic references (Köster 1997, Vargas et al. 2013, 2017). For the records prior to our study period, the number of pairs cannot be determined. Of the eight records of nests obtained during our study period, seven correspond to dis- tinct pairs. We differentiated breeding pairs because all nests observed coincided for a large part of the reproduction period (courtship, incu- bation, parental care in the nest and post-fledg- ing), in most cases on different cliffs, distant from each other. In addition to partially overlapping reproductive periods, the males were identified by the characteristics of the individually variable caruncles (Ríos-Uzeda & Wallace 2007, McGahan & Sale 2011, Houston et al. 2020), the females were differentiated by the moult process of the flight feathers (complete moult of the flight feathers of the wings or not). In all the nests we observed, the eggs were laid on the ground on sandy substrates and during pre-laying, incubation and parental care no adult was observed bringing material into the nest. This made it somewhat difficult to locate them.
The frequency of our visits depended on the bird activity at the nests. Active nests were visited at least four times per month and non-active nests, once per month. Observations occurred between 6:00 and 18:00 and were made far from the nests and perch sites to ensure no negative influence on the behavior of the nesting pairs under observation. We recorded the location of the nests, the activity in each nest: chicks, pairs or individuals of Andean Condors.
It was considered as a case of a partial overlap in the breeding season between pairs when two different pairs reproduced within the same time period, but they can be at different stages of their breeding. We consider the breeding period as the time that elapses between the laying of the egg and the end of the fledging dependency period. Pairs were classified as neighbours when two breeding pairs breed within the same breeding period. We consider sharing the same cliff when two different pairs breed on the same cliff regardless of whether it is the same breeding period.
Breeding success, measured as the number of chicks per year that fledge compared to the number of active nests was used as a reproductive parameter (Margalida et al. 2007) according to the classification of Cheylan (1981). To analyze the relationships between breeding success and nest occupations or nest elevation we carried out Fisher exact tests. This analysis was carried out in R program (R Development Core Team 2017). Nests were georeferenced using triangulation with the help of a compass and GPS in order to generate the least impact on the nesting site. The elevation was determined using a digital model of elevation (MAGAP 2020). We also calculated the mean distance and distance ranges between nests.
Between 1996 and 2019, 21 Andean Condor breed- ing attempts were recorded in 16 nest sites. The minimum distance recorded between the 16 nest sites was 25 m (range 25 to 87,278 m), at a mean elevation of 3478 m a.s.l. (SD 392 m, range 2930–4140 m). During our field study period, the minimum distance between the reproductive pairs of Andean Condors was 310 m (range 310 to 86,868 m) and a mean elevation of 3429 m a.s.l. (range 3200–4140 m).
In two areas we determined the nearest neighbour distance (NND) of Andean Condors on the same cliff was 556 m (mean 3047 m, SD = 1761.4, N = 3, range 556 to 4305 m) (Fig. 2; Area 1; nests; 1–3, pairs 1–3), on different cliffs 2720 m (only two pairs) (Fig. 2; Area 2; nests; 4–5, pairs 4–5) and in both areas the mean nearest neighbor distance recorded was 2370.889 m (SD = 1468.246, N = 4, range 556 to 4305 m) (Table 2).
There were two instances of cliff sharing in different areas. On one cliff, two consecutive, non- simultaneous nestlings were observed with males of the two pairs identified by the lobes of the male caruncles, but no differences could be seen between the females. The second case was of simultaneous sharing the same cliff with two pairs having partially overlapping breeding attempts. The first pair had a dependent male fledgling with an identifying mark while the second pair began breeding; both pairs were successful. The first pair’s fledgling remained close to the cliff until the second pair’s chick reached three months of age. Both pairs at this cliff shared 159 days.
The reproductive success for the Andean condor in the study area for the years 2018-2019 was 0.75 chicks per nest. When the nesting places used on one occasion were compared with those that were recurrent, we found statistically significant differences, with the pairs that bred in recurrent nests having greater success 1.0 vs 0.58Reproductive success was not associated with altitude, with the lower altitude areas being the most humanized.
We obtained unedited and unknown information on minimum nesting distances, elevation and breeding ecology of the Andean Condor in Ecuador. The distance of 25 m is the minimum recorded in 21 breeding attempt without differentiating breeding pairs and in different reproductive periods, and 310 m is the minimum distance recorded in partially overlapping breeding of seven pairs (during our fieldwork). These ranges will vary due to the presence of nearby areas that were not intensively inspected where more nests may exist. However, in two areas where we did search for nests intensively (Fig. 2), the mean NND between nests of different pairs and in the same reproductive periods was 2956.3 m (SD = 1532 m) and the distance between nearest neighbours sharing the same cliff was 556 m and 2720 m in different cliff. These would be the shortest distances described for the Andean Condor between breeding attempts of different breeding pairs, with the same, partially overlapping breeding season.
The mean distance between nesting events of California Condor pairs reaches 3800 m in a reduced breeding population (Snyder et al. 1986). In Andean Condors, the 2956.3 m mean distance between nests recorded in two different areas (Fig. 2) is slightly less than the value found for the California Condor. It is likely that this similarity could be associated with the small number of breeding pairs known for Ecuador.
Our observations of cliff sharing are unique. In one cliff we discovered two breeding pairs at different breeding stages using the same cliff, which is evidence of the possible presence of more breeding pairs in the area and the non-exclusivity of the cliff for one pair. The discovery of two breeding pairs of Andean Condor that shared the same cliff shows an unprecedented behaviour not described so far. Pairs of Andean Condors apply a solitary nesting pattern (Lambertucci 2007, Houston et al. 2020). Our observations show that in Andean Condor, solitary nesting can coincide with sharing cliffs by two nesting pairs.
The minimum distances between the sites of breeding attempts and average nearest neighbour distances that we found for the Andean Condor in our study are short when compared to the fact that condors often travel maximum flight distance 349.5 km/day (Lambertucci et al. 2014) or 362 km/day (Pavez 2014). These relatively short distances between nesting sites are probably a reflection of the availability of food resources, or that nesting sites are preferentially used or breeding areas are scarce. It is known that food resources directly impact breeding activity in the Andean Condor (Wallace & Temple 1988). A high quality habitat close to nesting sites could be an explanatory factor in understanding nearest-neighbour distances (Donázar et al. 1999). These measurements are variables not previously considered in ecological studies of the Andean Condor due to the limited information on its breeding ecology (Sáenz-Jiménez et al. 2016). Our information contributes to this information gap, but other social aspects of the reproductive dynamics of the Andean Condor could better explain these distances, therefore it is important to expand this type of research.
Nests most often occupied are most productive and have showed greater breeding success. This can be because the cliffs are inaccessible or the nest sites (nests) have some special structural and environmental characteristics, or particular breeding couples are specially good breeders. The presence of successful breeding pairs encourages other pairs to nest on the same or nearby cliffs. Indeed, in other species of raptors it was found that new pairs settled among nests that were already occupied (Margalida et al. 2008).
We did not record any losses of clutches, which suggests that the breeding success we measured may be overestimated. In the California Condor and other species of large vultures (i.e., Cinereous Vulture Aegypius monachus, Cape Vulture Gyps coprotheres) in populations with a similar conservation concerns, breeding success is slightly lower (Borello & Borello 2002, Terrasse et al. 2004, Mee et al. 2007, Freund et al. 2017) than that recorded for the Andean Condor in this study. Our research shows that out of the nesting failures we observed, two were in disturbed areas where management actions are immediately needed.
Finally, our results highlight the importance of monitoring nesting areas and create new concerns for the conservation of the Andean Condor. It is likely that the number of breeding pairs and nesting areas are being underestimated. The nesting sites and roosts of the Andean Condor present an interesting dynamics about which little is known (Lambertucci et al. 2008). We now know that condor pairs can share the same cliff and nests can be recorded over very short distances. Our results support the view that the conservation of known roost networks would be a good conservation strategy (Kusch 2004, Lambertucci et al. 2008). We hope that in the short term, effective management strategies around breeding ecology are developed for the conservation and persistence of the Andean Condor in the Ecuadorian Andes.
BIBLIOGRAFIA
Astore V., Estrada R., Jácome N. L. 2017. Reintroduction strategy for the Andean Condor conservation program, Argentina. Int. Zoo Yearb. 51: 124–136.
Avellaneda L. M., Tomás E., León S., Esperanza T. 2018. Impact of potato cultivation and cattle farming on physicochemical parameters and enzymatic activities of Neotropical High Andean páramo ecosystem soils. Sci. Total Environ. 631–632: 1600–1610.
Buytaert W., Célleri T., De Bièvre B., Cisneros F., Wyseure G., Deckers J., Hofstede R. 2006. Human impact on the hydrology of the Andean Páramos. Environ. Sci. 79: 53.
Cheylan G. 1981. Description des principaux paramètres de la reproduction. Rapaces Méditerranéens. 1: 3–5.
Christmann T., Oliveras I. 2020. Nature of alpine ecosystems in tropical mountains of South America. In: Goldstein M. I., DellaSala D. A. (eds). Encyclopedia of the World’s Biomes. Elsevier, Amsterdam, pp. 282–291.
González, L. M., Oria, J., Sánchez, R., Margalida, A., Aranda, A., Prada, L., … & Molina, J. I. (2008). Status and habitat changes in the endangered Spanish Imperial Eagle Aquila adalberti population during 1974–2004: implications for its recovery. Bird Conservation International, 18(3), 242-259.
Gargiulo C. 2012. Distribución y situación actual del Cóndor Andino (Vultur gryphus) en las sierras centrales de Argentina. Buenos Aires, Argentina. Ph.D. Thesis. Universidad de Buenos Aires.
Heredia J., Piedrabuena J. 2010. Registros de nidificación del Cóndor Andino (Vultur gryphus) en las Sierras Grandes de Córdoba, Argentina. Nuestras Aves 55: 37–39.
Hofstede R., Coppus R., Vásconez P. M., Segarra P. P., Wolf J., Sevink J. 2002. The conservation status of tussock grass paramo in Ecuador. Ecotropicos 15: 3–18.
Houston D., Kirwan G. M., Christie D. A., Sharpe C. J. 2020. Andean Condor (Vultur gryphus). In: del Hoyo J., Elliott A., Sargatal J., Christie D. A., de Juana E. (eds). Birds of the World, version 1.0. Cornell Lab of Ornithology, Ithaca, NY, USA. Available at: https://doi.org/10.2173/bow.andcon1.01.
IUCN 2020. The IUCN Red List of Threatened Species. Version 2020-3. Available at https://www.iucnredlist.org, accessed 17 Dec. 2020.
Josse C., Aguirre Z. 2013. Arbustal siempreverde montano del norte de los Andes. In: Ministerio del Ambiente del Ecuador (ed.). Sistema de Clasificación de los Ecosistemas del Ecuador Continental. Subsecretaría de Patrimonio Natural, Quito, Ecuador, pp. 76–77.
Koford C. B. 1953. The California Condor. Natl. Audubon Soc. Res. Rep. 4.
Köster F. 1997. Los Cóndores de Papallacta. Instituto Ecuatoriano Forestal y de Áreas Naturales y Vida Silvestre (INEFAN), Empresa Municipal de Agua Potable y Alcantarillado de Quito (EMAAP-Q), Fundación Rumicocha y Fundación Ornitológica del Ecuador (CECIA). Impresiones Signo, Quito, Ecuador.
Lambertucci S. 2007. Biología y conservación del Cóndor Andino (Vultur gryphus) en Argentina. El Hornero 22: 149– 158.
Lambertucci S. A., Speziale K. L. 2009. Some possible anthropogenic threats to breeding andean condors (Vultur gryphus). J. Raptor Res. 43: 245–249.
Lambertucci S. A., Ruggiero A. 2013. Cliffs used as communal roosts by Andean Condors protect the birds from weather and predators. PLoS One 8(6): 1–8.
Lambertucci S. A., Alarcón P. A. E., Hiraldo F., Sanchez-Zapata J. A., Blanco G., Donázar J. A. 2014. Apex scavenger movements call for transboundary conservation policies. Biol. Conserv. 170: 145–150.
MAE (Ministerio del Ambiente del Ecuador). 2013. Sistema de Clasificación de los Ecosistemas del Ecuador Continental. Subsecretaría de Patrimonio Natural. Quito.
MAE (Ministerio del Ambiente del Ecuador) 2017. Mapa Interactivo Ambiental. Sistema Nacional de Áreas Protegidas SNAP. available at: http://ide.ambiente.gob.ec/ mapainteractivo/. Accessed 8 Jan. 2019.
MAGAP (Ministerio de Agricultura y Ganadería del Ecuador). 2020. Modelo Digital del Terreno (MDT) de Ecuador (resolución 3–5m). Available at:http://geoportal.agricultura. gob.ec/geonetwork/srv/spa/catalog.search#/metadata/MD T_SIGTIERRAS_16092016
McGahan J., Sale L. 2011. The Andean Condor: A field study. Available at: https://archive.org/details/TheAndeanCondor AFieldStudy.
Margalida A., González L. M., Sánchez R., Oria J., Prada L., Caldera J., Aranda A., Molina J. I. 2007. A long-term largescale study of the breeding biology of the Spanish imperial eagle (Aquila adalberti). J. Ornithol. 148: 309–322.
Mateos, R. S., & Gallo-Viracocha, F. (2023). Minimum Nest Distances, Breeding Success and Use of Shared Cliffs for Andean Condor Vultur gryphus Breeding in Ecuador. Acta Ornithologica, 58(1), 127-133.
Morocho C. C., Chuncho G. 2019. Páramos del Ecuador, importancia y afectaciones: Una revisión. Bosques Latitud. Cero 9: 71–83.
Negro J. J., Hiraldo F. 1993. Nest-site selection and breeding success in the Lesser Kestrel Falco naumanni. Bird Study 40: 115–119.
Pavez E. F. 2014. Patrón de movimiento de dos cóndores andinos Vultur gryphus (Aves: Cathartidae) en los andes centrales de Chile y Argentina. Boletín Chil. Ornitol. 20(2): 1–12.
Podofillini S., Cecere J. G., Griggio M., Curcio A., et al. 2018. Home, dirty home: Effect of old nest material on nest-site selection and breeding performance in a cavity-nesting raptor. Curr. Zool. 64: 693–702.
Restrepo-Cardona J. S., Sáenz-Jiménez F., Echeverry-Galvis M. Á., Betancur A., Quintero A. F., López P. A. 2018. Breeding behavior of a reintroduced pair of Andean condor (Vultur gryphus) in the central Andes of Colombia. Ornitol. Neotrop. 29: 129–133.
R Development Core Team 2017. R: A language and environment for statistical computing. Available at: http://www.rproject.org.
Ríos-Uzeda B., Wallace R. B. 2007. Estimating the size of the Andean Condor population in the Apolobamba Mountains of Bolivia. J. Field Ornithol. 78:170–175.
Sáenz-Jiménez F., Parrado-Vargas A., Pérez-Torres J., Sheppard J. K., Ciri F. 2016. Andean condor (Vultur gryphus) nesting in northeastern Colombia and differences in laying dates along the Andes. Ornitol. Neotrop. 27: 67–71.
Santiana J., Báez S., Guevara J. 2013. Bosque siempreverde montano alto del Norte de la Cordillera Oriental de los Andes. In: Ministerio del Ambiente del Ecuador 2013. Sistema de Clasificación de los Ecosistemas del Ecuador Continental. Ministerio del Ambiente del Ecuador, Quito, pp. 115–117.
Sierra R. 2013. Patrones y factores de Deforestación en el Ecuador Continental. Y un acercamiento a los próximos 10 ańos. Conservación Internacional Ecuador y Forest Trends, Quito, Ecuador.
Snyder N. F. R., Hamber J. A. 1985. Replacement-clutching of California Condors. Condor 87: 374–378.
Snyder N. F. R., Ramey R. O. B. R., Sibley F. C. 1986. Nest-site biology of the California Condor. Condor 88: 228–241.
Terrasse M., Sarrazin F., Choisy J.-P., Clémente C., Henriquet S., Lécuyer P., Pinna J., Tessier C. 2004. A success story: the reintroduction of Eurasian Griffon Gyps fulvus and Black Aegypius monachus Vultures to France. In: Meyburg B. U., Chancellor R. D. (eds). Raptors Worldwide. Proceedings of VI World Conference on Birds of Prey and Owls. WGBP/MME, Budapest, Hungary, pp. 127–145.
Vargas H., Ortega A., Kohn S., Carrion J. M., Parish C. 2013. Investigación y monitoreo ecológico del cóndor andino en Ecuador. Periodo: Octubre 2012–Diciembre 2013. The Peregrine Fund y Grupo Nacional de Trabajo del Cóndor Andino. Quito, Ecuador.
Vargas H., Kohn S., Ortega A., Arbeláez E., Naveda-Rodriguez A., Cardoso F., Chávez J. 2017. Investigación y Monitoreo Ecológico del Cóndor Andino en Ecuador. Informe Técnico 2012–2016. The Peregrine Fund — Grupo Nacional de Trabajo del Cóndor Andino. Quito, Ecuador.
Wallace M. P., Temple S. A. 1987. Releasing captive-reared Andean Condors to the wild. J. Wildl. Manage. 51: 541–550.




